আমাদের প্রাত্যহিক জীবনের বিভিন্ন ক্ষেত্রে বায়ু, পানি, লোহা, খাদ্যদ্রব্য, বইপুস্তক, চক ইত্যাদি নানা রকম জিনিস বা পদার্থ ব্যবহার করি। এদের মধ্যে কোনোটি মৌলিক পদার্থ, কোনোটি যৌগিক পদার্থ আবার কোনোটি বিভিন্ন পদার্থের মিশ্রণ। প্রতিটি পদার্থ কী দিয়ে তৈরি বা এদের গঠন কেমন ও কীভাবে তৈরি হয় তা কি তোমরা জান?

এ অধ্যায় পাঠ শেষে আমরা
আমাদের চার পাশে সবসময়ই কোনো না কোনো পদার্থ দেখতে পাই। যেমন বই-খাতা, চেয়ার, টেবিল, পানি, বাতাস, ইত্যাদি। এগুলোর কোনো কোনোটি আমরা বিভিন্ন কাজে ব্যবহারও করি। সকালবেলা ঘুম থেকে উঠেই আমরা হাত-মুখ ধোয়ার কাজে পানি ব্যবহার করি। এই পানি একটি পদার্থ। একইভাবে চক, চিনি, লবণ, লোহা, তামা, ইত্যাদি সবই পদার্থ। এসব পদার্থের উপাদান কী বা এরা কী দিয়ে তৈরি?
পদার্থের ভিন্নতার কারণ কী?
পদার্থের ভিন্নতার প্রধান কারণ হলো এর উপাদান (constituent)। এছাড়া পদার্থের গঠন (stucture) এর উপরও এদের ধর্ম নির্ভর করে। একেক পদার্থের উপাদান ও গঠন একেক রকম বলে তারা দেখতে ভিন্ন ভিন্ন রকম হয়। ধর্ম অনুযায়ী ভিন্ন ভিন্ন পদার্থ ভিন্ন ভিন্ন কাজে ব্যবহৃত হয়।
এবার আমাদের বহুল ব্যবহৃত কয়েকটি পদার্থ কী দিয়ে তৈরি তা দেখা যাক। প্রথমে লোহা ও তামার কথাটি ধরি। আমরা লোহা বিভিন্ন কাজে ব্যবহার করি। এক টুকরা লোহা মূলত ছোটো ছোটো লোহার কণা দিয়ে তৈরি। তামার ক্ষেত্রেও তাই। এটি ছোট ছোট তামার কণা দিয়ে তৈরি। লোহাকে ভাঙ্গলে শুধু লোহারই ক্ষুদ্র ক্ষুদ্র কণা পাওয়া যায়। অর্থাৎ লোহাতে একটি মাত্র উপাদান বিদ্যমান। একইভাবে তামাকে ভাঙলে শুধু তামারই ক্ষুদ্র ক্ষুদ্র কণা পাওয়া যায় এবং এতেও একটিমাত্র উপাদান বিদ্যমান।

চিত্র-৬.১: লোহা ও তামার ক্ষুদ্র কণাসমূহ নিয়মিত সজ্জায় রয়েছে
লোহা ও তামার মতো যে সকল পদার্থ একটি মাত্র উপাদান দিয়ে তৈরি, তাদেরকে আমরা বলি মৌলিক পদার্থ।
লোহা ও তামার মতো আমাদের পরিচিত হাইড্রোজেন ও অক্সিজেন একটি করে উপাদান দিয়ে তৈরি এবং এরাও মৌলিক পদার্থ।

চিত্র-৬.২: হাইড্রোজেন ও অক্সিজেন গ্যাসের ক্ষুদ্র কণাসমূহ নিয়মিত সজ্জায় নাই
আমাদের দৈনন্দিন জীবনের দুটি অত্যাবশ্যকীয় পদার্থ হলো লবণ ও চিনি। লবণ হলো সোডিয়াম ও ক্লোরিন নামের দুই রকম উপাদান দিয়ে তৈরি একটি পদার্থ। আর চিনি হলো কার্বন, হাইড্রোজেন ও অক্সিজেন নামের তিনটি ভিন্ন উপাদান দিয়ে তৈরি।
আমরা যদি লবণকে অর্থাৎ সোডিয়াম ক্লোরাইডকে ভাঙতে থাকি, তবে প্রথমে লবণের বড়ো দানা থেকে প্লেটে বা ক্ষুদ্র দানা পাবো। প্রাপ্ত ছোটো দানাগুলি আরও ক্ষুদ্র দানা এবং একপর্যায়ে একেবারে ক্ষুদ্রতম দানায় পরিণত হবে, যেটিকে খালি চোখে আর দেখা যাবে না। যদিও এটি লবণের একটি অতি ক্ষুদ্রতম অংশ, যেখানে একটি মাত্র সোডিয়াম ক্লোরাইড আছে। এই অংশ ভাঙলে তা দুই ভাগে বিভক্ত হয়ে সোডিয়াম ও ক্লোরিন হয়ে যায়, অর্থাৎ দুটি ভিন্ন উপাদান পাওয়া যায়।
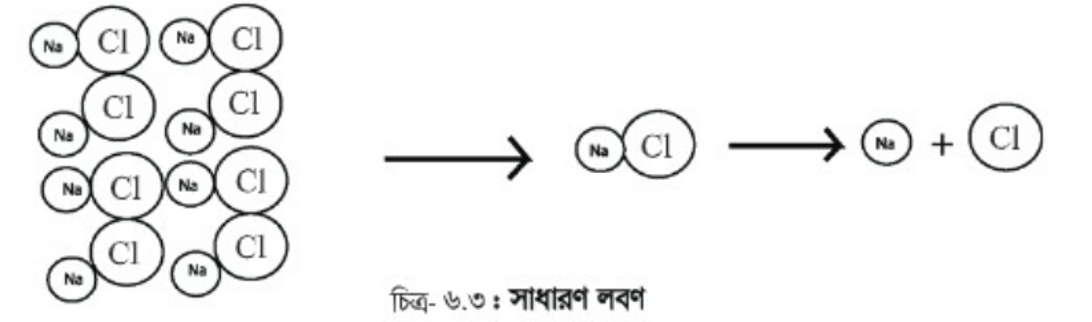
একই ভাবে চিনিকে ভাঙলে শেষ পর্যন্ত কার্বন, হাইড্রোজেন ও অক্সিজেন, এই তিনটি উপাদান বা মৌলিক পদার্থ পাওয়া যাবে।
লবণ ও চিনির মতো যে সব পদার্থ একের অধিক ভিন্নধর্মী উপাদান বা মৌলিক পদার্থ দিয়ে তৈরি তাদেরকে আমরা বলি যৌগিক পদার্থ। লোহায় মরিচা ধরার কথা আমরা কে না জানি। ধূসর কালচে রঙের লোহার তৈরি রড (যা একটি মৌলিক পদার্থ কিছুদিন বাইরে রেখে দিলে এর উপর লালচে বাদামি রঙের একটি আস্তরণ পড়ে, যার নাম মরিচা। এখানে আসলে একটি মৌলিক পদার্থ (লোহা) জলীয় বাষ্পের উপস্থিতিতে অপর একটি মৌলিক পদার্থ অক্সিজেনের সাথে বিক্রিয়ার মাধ্যমে মরিচার সৃষ্টি করে, যা আয়রন অক্সাইড নামের একটি যৌগিক পদার্থ। তাহলে এ কথা নিঃসন্দেহে বলা যায় যে, দুই বা ততোধিক মৌলিক পদার্থ মিলে একটি যৌগিক পদার্থ তৈরি হয়।
মিশ্র পদার্থ: একটি গ্লাসে পানি নিয়ে তাতে সমান্য একটু লবণ যোগ করে নাড়া দাও। লবণ ও পানির এই মিশ্রণ, যেখানে একের অধিক পদার্থ বিদ্যমান সেটি হলো মিশ্র পদার্থ। একই ভাবে, বায়ুও এক ধরনের মিশ্র পদার্থ যেখানে নাইট্রোজেন, অক্সিজেন, জলীয়বাষ্পসহ অন্যান্য পদার্থ থাকে। এখানে লক্ষ্যণীয় যে, বায়ু এমন একটি মিশ্র পদার্থ যেখানে মৌলিক ও যৌগিক উভয় ধরনের পদার্থ রয়েছে। আবার লবণ পানির মিশ্রণে উপস্থিত লবণ ও পানি দুটিই যৌগিক পদার্থ।
আগের পাঠে আমরা দেখেছি, মৌলিক বা যৌগিক পদার্থকে ক্রমাগত ভাঙতে ভাঙতে এক পর্যায়ে এটি ক্ষুদ্রতম কণায় পরিণত হয়। এই ক্ষুদ্রতম কণার বিষয়ে বিভিন্ন সময়ে বিজ্ঞানী ও দার্শনিকগণ নানা রকম মতবাদ ব্যক্ত করেছেন। গ্রিক দার্শনিক ডেমক্রিটাস (Democritus) খ্রিষ্টপূর্ব ৪০০ অব্দে সর্বপ্রথম পদার্থের ক্ষুদ্রতম কণা নিয়ে মতবাদ প্রদান করেন। তাঁর মতে সকল পদার্থই ক্ষুদ্র ক্ষুদ্র অবিভাজ্য (যা আর ভাঙা যায় না) কণা দিয়ে তৈরি। তিনি এই ক্ষুদ্রতম কণার নাম দেন পরমাণু বা এটম। এটম কথাটি তিনি নিয়েছিলেন গ্রিক শব্দ এটমস (atomos) থেকে, যার অর্থ হলো অবিভাজ্য (indivisible) বা যা ভাঙা যায় না। তাঁর সমসাময়িক আরও দুজন দার্শনিক প্লেটো (Plato) এবং অ্যারিস্টটল (Aristotle) তাঁর মতবাদের সাথে দ্বিমত পোষণ করেন। অ্যারিস্টটলের মতে, পদার্থসমূহ অবিচ্ছিন্ন (continuous) এবং ভাঙনের কোনো সীমা নেই অর্থাৎ যতই ভাঙা হোক না কেন, পদার্থের কণাগুলো ক্ষুদ্র হতে ক্ষুদ্রতর হতে থাকবে।
১৮০৩ সালে জন ডাল্টন (John Dalton) নামের ইংরেজ বিজ্ঞানী পরীক্ষালব্ধ তথ্যের উপর ভিত্তি করে পদার্থের ক্ষুদ্রতম কণা সম্পর্কে তাঁর মতবাদ দেন। তাঁর এই মতবাদ ডাল্টনের পরমাণুবাদ নামেই পরিচিত। ডাল্টনের মতে-
১। মৌলিক পদার্থসমূহ পরমাণু নামক ক্ষুদ্র ক্ষুদ্র কণা দিয়ে গঠিত।
২। একটি মৌলের বা মৌলিক পদার্থের সকল পরমাণু একই রকম। একটি মৌলের সকল পরমাণুর আকার, ভর ও রাসায়নিক ধর্ম একই।
৩। একটি মৌলের পরমাণুসমূহ অপর মৌলের পরমাণুসমূহ হতে ভিন্ন রকম। অর্থাৎ ভিন্ন ভিন্ন মৌলের পরমাণুর আকার, ভর ও বিভিন্ন ধর্ম ভিন্ন ভিন্ন।
৪। যৌগিক পদার্থসমূহ একের অধিক মৌলিক পদার্থ দিয়ে গঠিত। বিভিন্ন মৌলের পরমাণুসমূহ সরল অণুপাতে যুক্ত হয়ে যৌগিক পদার্থ বা যৌগ তৈরি করে।
৫। একটি রাসায়নিক বিক্রিয়ায় পরমাণুসমূহের সৃষ্টি বা ধ্বংস হয় না। শুধু একে অপরের সাথে যুক্ত হয় বা একে অন্য থেকে আলাদা হয়।
আমরা ডাল্টনের মতবাদ থেকে জানলাম যে, পদার্থ ক্ষুদ্র ক্ষুদ্র কণা দিয়ে গঠিত। এ ক্ষুদ্র কণাদেরকে পরমাণু বলা হয়। তবে পরমাণু সাধারণত স্বাধীন বা মুক্ত অবস্থায় থাকতে পারে না। এরা একে অন্যের সাথে যুক্ত হয়ে অণু গঠন করে। অণুরা মুক্ত অবস্থায় থাকতে পারে।
মৌলিক পদার্থের বেলায় শুধু ঐ পদার্থের পরমাণুরা যুক্ত হয়ে অণু গঠন করে। যেমন দুটি অক্সিজেন পরমাণু যুক্ত হয়ে একটি অক্সিজেন অণু গঠন করে।
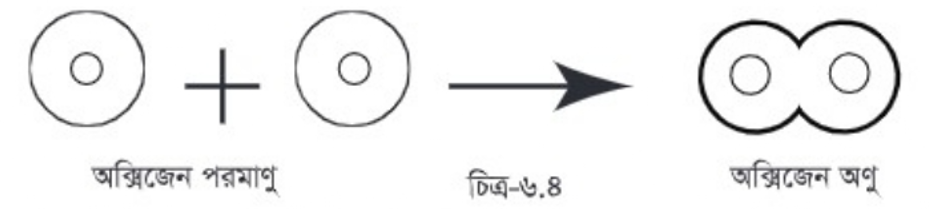
অন্যভাবে বলা যায়, অক্সিজেন নামের মৌলিক পদার্থ ক্ষুদ্র ক্ষুদ্র অণু দ্বারা গঠিত। আবার অক্সিজেনের একটি অণুকে ভাঙলে অক্সিজেনের দুটি পরমাণু পাওয়া যাবে।
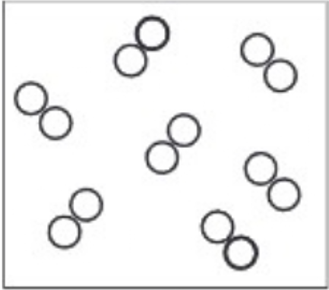
চিত্র-৬.৫: একটি পাত্রে অক্সিজেন গ্যাস। অণুগুলো মুক্ত অবস্থায় আছে
এবার একটি যৌগিক পদার্থ যেমন পানির কথা বিবেচনা করি। একটি পাত্রে কয়েক ফোঁটা পানি নিয়ে একে ক্ষুদ্র ক্ষুদ্র অংশে ভাগ করতে থাকি। ধরা যাক, এক পর্যায়ে আমরা ছোট্ট এক ফোঁটা পানি পাব। সেই এক ফোঁটা পানিও অসংখ্য কণার সমষ্টি।
এক পর্যায়ে হয়ত আমরা একটিমাত্র পানির কণা পাবো যে কণাতে পানির বৈশিষ্ট্য বজায় থাকে। এই ক্ষুদ্র কণাটি হলো পানির অণু। পানির একটি অণু মুক্ত অবস্থায় থাকতে পারে।
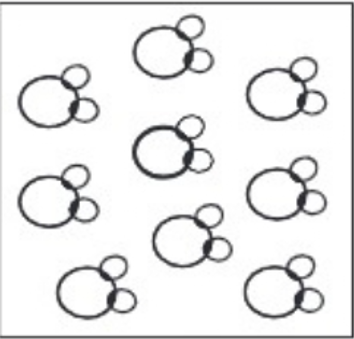
চিত্র-৬.৬: পানি আসলে পানির অণুর সমষ্টি
একটি পানির অণুকে ভাঙলে আরও ক্ষুদ্র কণা পাওয়া যায়, তবে সেগুলো স্বাধীনভাবে থাকতে পারে না। সেগুলো পানির বৈশিষ্ট্যও ধারণ করে না। আসলে তারা আর পানির কণা থাকে না। একটি পানির অণুকে ভাঙলে একটি অক্সিজেন পরমাণু ও দুটি হাইড্রোজেন পরমাণু পাওয়া যায়। অন্যভাবে বলা যায় একটি অক্সিজেন পরমাণু ও দুটি হাইড্রোজেন পরমাণু যুক্ত হয়ে একটি পানির অণু গঠন করেছে।
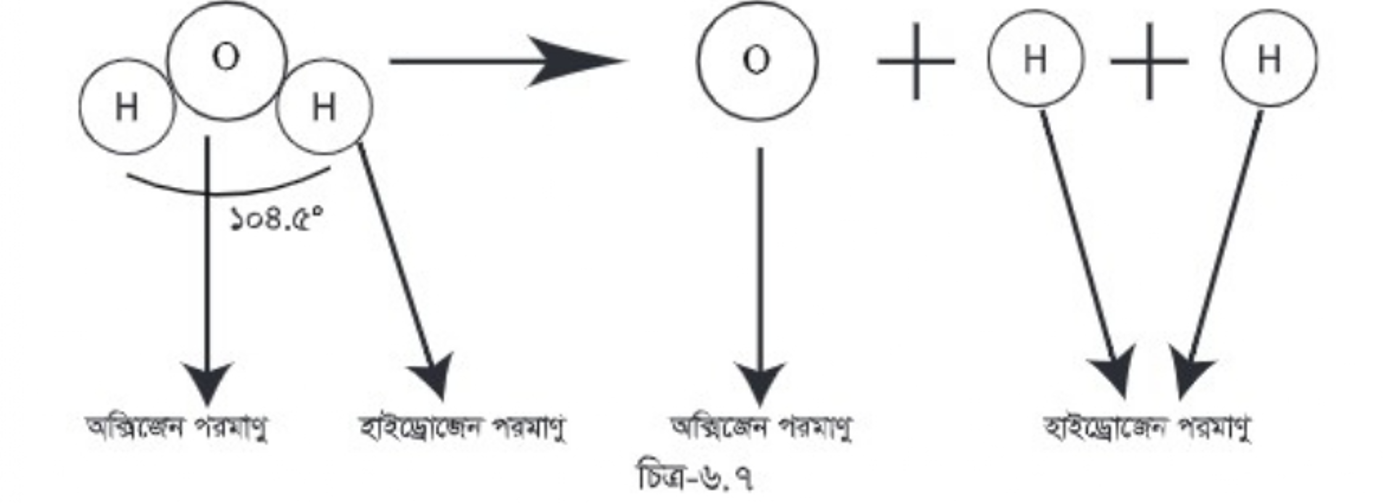
| কাজ: গোলাকার সহজলভ্য কোন বস্তু যেমন: আলু বা কাঁদামাটির তৈরি মার্বেল ও কাঠি দিয়ে পানি ও অক্সিজেন অণুর মডেল তৈরি কর। হাইড্রোজেন পরমাণুদ্বয় অক্সিজেন পরমাণুতে ১০৪.৫° কোণ তৈরি করে। |
তাহলে পরমাণু ও অণুর পার্থক্য ও সর্ম্পক বোঝা গেল?
পরমাণু নামক ক্ষুদ্র কণা দ্বারা পদার্থ গঠিত। এরা স্বাধীন অবস্থায় থাকতে পারে না। দুই বা ততোধিক পরমাণু মিলে অণু গঠন করে। একই ধরনের পরমাণু মিলে মৌলিক পদার্থের অণু গঠন করে। আর দুই বা ততোধিক পদার্থের পরমাণু মিলে যৌগিক পদার্থের অণু গঠন করে। অণু স্বাধীনভাবে থাকতে পারে।
আগের পাঠে তোমরা জেনেছ যে, ভিন্ন ভিন্ন মৌলের পরমাণু ভিন্ন ভিন্ন হয়। এখন প্রশ্ন হলো, সর্বমোট কতগুলি মৌল বা মৌলিক পদার্থ আছে অথবা কত রকমের পরমাণু আছে? এ পর্যন্ত ১১৮টি মৌলিক পদার্থ আবিষ্কৃত হয়েছে যার মধ্যে ৯৮টি প্রকৃতিতে পাওয়া যায় আর বাকি ২০টি কৃত্রিমভাবে তৈরি মৌলিক পদার্থ। প্রতিটি মৌলিক পদার্থেরই একটি নাম আছে। আর এদেরকে সংক্ষিপ্ত ও সুবিধাজনকভাবে প্রকাশের জন্যই আমরা প্রতিটির জন্য আলাদা প্রতীক ব্যবহার করি। প্রতীক সাধারণত মৌলের ল্যাটিন, গ্রিক বা ইংরেজি নামের একটি বা দুটি আদ্যক্ষর দ্বারা প্রকাশ করা হয়। একটি অক্ষর দিয়ে প্রকাশিত প্রতীকের ক্ষেত্রে সর্বদাই বড় হাতের অক্ষর আর দুটি অক্ষর দিয়ে প্রকাশিত প্রতীকের ক্ষেত্রে প্রথমটি বড়ো হাতের অক্ষর এবং পরেরটি ছোট হাতের অক্ষর হয়। নিচে কয়েকটি পরমাণুর প্রতীক ও তাদের ইংরেজি, গ্রিক বা ল্যাটিন নাম দেয়া হলো।
| পরমাণু | প্রতীক | ইংরেজি, গ্রিক বা ল্যাটিন নাম |
| হাইড্রোজেন | H | Hydrogen |
| হিলিয়াম | He | Helium |
| লিথিয়াম | Li | Lithium |
| বেরিলিয়াম | Be | Beryllium |
| বোরন | B | Boron |
| কার্বন | C | Carbon |
| নাইট্রোজেন | N | Nitrogen |
| অক্সিজেন | 0 | Oxygen |
| ফ্লোরিন | F | Fluorine |
| লোহা | Fe | Ferrum (Iron) |
আমরা শিখেছি যে, দুই বা ততোধিক পরমাণু একত্রে যুক্ত হয়ে অণু তৈরি করে। একটি অণুতে কী কী পরমাণু আছে সেটা জানা যায় সংকেত থেকে।
আসলে অণুর সংক্ষিপ্ত প্রকাশই হলো সংকেত। একটি অণু যে যে মৌলের পরমাণু দিয়ে গঠিত সেসব মৌলের প্রতীক দিয়ে সংকেত লেখা হয়। আমরা এখন সংকেত লেখার নিয়ম ও সংকেত থেকে কী বোঝা যায় সে সম্পর্কে জানব।
মৌলিক পদার্থের সংকেত: কঠিন বা তরল মৌলিক পদার্থের ক্ষেত্রে সাধারণত দেখা যায় অনেক পরমাণু একসাথে থাকে, কোনো অণু গঠন করে না। তাই এ ধরনের মৌলের ক্ষেত্রে অণুর সংকেত লেখা হয় না। যেমন, সোডিয়াম, লোহা, কপার ইত্যাদি। তবে গ্যাসীয় মৌলসমূহের ক্ষেত্রে সাধারণত দুটি পরমাণু যুক্ত হয়ে অণু গঠন করে। এজন্য তাদের সংকেত লেখা হয় প্রতীকের নিচে ডানপাশে ছোটো করে 2 লিখে। যেমন অক্সিজেনের সংকেত O2, নাইট্রোজেনের সংকেত N2। তবে কিছু কিছু তরল ও কঠিন মৌলের ক্ষেত্রেও দুটি পরমাণু যুক্ত হয়ে অণু গঠন করে। তাদেরও সংকেত লেখা হয় প্রতীকের নিচে ডানপাশে ছোটো করে 2 লিখে। যেমন ব্রোমিন (তরল) এর সংকেত Br2। নিচে কিছু মৌলের সংকেত দেয়া হলো
| মৌল | প্রতীক | অণুর সংকেত |
| হাইড্রোজেন | H | H2 |
| নাইট্রোজেন | N | N2 |
| অক্সিজেন | 0 | 02 |
| ফ্লোরিন | F | F2 |
| ক্লোরিন | C1 | C12 |
| ব্রোমিন | Br | Br2 |
| আয়োডিন | I | I2 |
যৌগিক পদার্থের সংকেত: যৌগিক পদার্থের সংকেত থেকে বোঝা যায় যৌগটি কী কী মৌল বা পরমাণুগুচ্ছ দিয়ে এবং কী অনুপাতে তৈরি। যেমন পানির সংকেত H2O থেকে বোঝা যায় একটি পানির অণু দুটি হাইড্রোজেন পরমাণু ও একটি অক্সিজেন পরমাণু থেকে তৈরি। নিচের ছক থেকে আমরা দেখব কীভাবে সংকেত থেকে বোঝা যায় যৌগটি কী কী দিয়ে তৈরি।
| যৌগের নামের বৈশিষ্ট্য | সংকেত | নাম | যে যে মৌলের পরমাণু ও পরমাণুগুচ্ছ দিয়ে তৈরি |
| ধাতুর (কিছু ক্ষেত্রে অধাতু) সাথে একটি অধাতু যুক্ত হলে যৌগের নামের শেষে আইড থাকে। | NaCl CaO KI SO2 CO2 | সোডিয়াম ক্লোরাইড ক্যালসিয়াম অক্সাইড পটাশিয়াম আয়োডাইড সালফার ডাইঅক্সাইড কার্বন ডাইঅক্সাইড | সোডিয়াম ও ক্লোরিন ক্যালসিয়াম ও অক্সিজেন পটাশিয়াম ও আয়োডিন সালফার ও অক্সিজেন কার্বন ও অক্সিজেন |
| একটি অধাতু ও কয়েকটি অক্সিজেন মিলে একটি পরমাণুগুচ্ছ তৈরি করে যা একটিমাত্র পরমাণুর মতো কাজ করে। ঐ পরমাণুগুচ্ছ ধাতুর সাথে যুক্ত হয়ে যৌগ গঠন করলে তাদের নামের শেষে আইট বা এট থাকে। | CaSO4 CaSO3 KNO3 KNO2 Na2(CO3) AIPO4 | ক্যালসিয়াম সালফেট ক্যালসিয়াম সালফাইট পটাশিয়াম নাইট্রেট পটাশিয়াম নাইট্রাইট সোডিয়াম কার্বনেট অ্যালুমিনিয়াম ফসফেট | ক্যালসিয়াম ও সালফেট ক্যালসিয়াম ও সালফাইট পটাশিয়াম ও নাইট্রেট সোডিয়াম ও কার্বনেট অ্যালুমিনিয়াম ও ফসফেট |
পরবর্তী শ্রেণিতে তোমরা যৌগিক পর্দাথের সংকেত লেখার নিয়ম সম্পর্কে জানবে।
পরমাণু আকারে খুবই ছোটো। এতই ছোটো যে, খালি চোখে এদের দেখা যায় না। এমনকি সাধারণ মাইক্রোস্কোপ যন্ত্রের সাহায্যেও না। তবে ইলেকট্রন মাইক্রোস্কোপের সাহায্যে পরমাণু দেখা যেতে পারে। এখানে উল্লেখ্য যে ইলেকট্রন মাইক্রোস্কোপের মাধ্যমে কোনো জিনিসকে তার আকারের তুলনায় কয়েক মিলিয়ন গুণ বড় দেখা যায়।
এখন প্রশ্ন হলো, এত ছোটো পরমাণুকে ভেঙে কি আরও ক্ষুদ্রতর কোনো কণা পাওয়া যায়?
ডাল্টনের পরমাণুবাদ অনুযায়ী, পরমাণু অবিভাজ্য অর্থাৎ একে আর ভাঙা যায় না। ডাল্টনের এই মতটি অনেকদিন পর্যন্ত সবাই সমর্থন করলেও এখন এটি প্রমাণিত সত্য যে, পরমাণুকে ভেঙে আরও ক্ষুদ্র কণায় পরিণত করা যায়। পরমাণু ভেঙে মূলত যে তিনটি কণা পাওয়া যায় তা হলো ইলেকট্রন, প্রোটন ও নিউট্রন। আধুনিক গবেষণায় এটি প্রমাণিত যে, পরমাণুর কেন্দ্রে থাকে নিউট্রন ও প্রোটন আর কেন্দ্রের চারদিকে বৃত্তাকার কক্ষপথে ইলেকট্রন ঘুরতে থাকে। একই ধরনের একটি পরমাণুতে সমানসংখ্যক ইলেকট্রন ও প্রোটন থাকে।
এখানে উল্লেখ্য যে একমাত্র হাইড্রোজেন পরমাণুর কেন্দ্রে কোনো নিউট্রন থাকে না, অর্থাৎ হাইড্রোজেন পরমাণু ভাঙলে এর কেন্দ্রে একটি প্রোটন ও বাইরে একটি ইলেকট্রন পাওয়া যায়। অন্যদিকে হিলিয়াম পরমাণুর কেন্দ্রে থাকে ২টি প্রোটন ও দুটি নিউট্রন আর বাইরে থাকে ২টি ইলেকট্রন। আবার অক্সিজেন পরমাণুর কেন্দ্রে থাকে ৮টি প্রোটন ও ৮টি নিউট্রন আর বাইরে থাকে ৮টি ইলেকট্রন।

ষষ্ঠ শ্রেণিতে তোমরা জেনেছ যে, পানি একটি সার্বজনীন দ্রাবক। কারণ, এটি জৈব ও অজৈব অনেক দ্রবকে দ্রবীভূত করে যা অন্য দ্রাবকের পক্ষে সম্ভব নয়। এবার তাহলে দেখা যাক পানি সত্যিকার অর্থেই সার্বজনীন দ্রাবক কিনা।
কাজ: সার্বজনীন দ্রাবক হিসেবে পানির ব্যবহার প্রদর্শন। প্রয়োজনীয় উপকরণ: পানি, টেস্টটিউব, নানা রকম পদার্থ (যেমন- খাবার লবণ, খাবার সোডা, টেস্টিং সল্ট, বিট লবণ, ফিটকিরি, চিনি, ভিনেগার, স্পিরিট, ভিটামিন সি ট্যাবলেট, গ্লুকোজ ইত্যাদি) পদ্ধতি: টেস্টটিউবে ৫ মিলিলিটারের মতো পানি নাও। কিছু খাবার লবণ যোগ করে ভালোভাবে ঝাকাও। লবণ কি পানিতে দ্রবীভূত হয়ে গেল? হ্যাঁ, ঠিক তাই। একই ভাবে একে একে উপরে উল্লেখিত প্রতিটি দ্রব নিয়ে দেখ এরা পানিতে দ্রবীভূত হয় কিনা। প্রতিটি দ্রব বা পদার্থই পানিতে দ্রবীভূত হচ্ছে। উল্লেখিত পদার্থের মধ্যে খাবার লবণ, খাবার সোডা, টেস্টিং সল্ট, বিট লবণ, ফিটকিরি হলো অজৈব পদার্থ কিন্তু চিনি, ভিনেগার, স্পিরিট, ভিটামিন সি ট্যাবলেট, গ্লুকোজ হলো জৈব পদার্থ। তাহলে এটি প্রমাণিত হলো যে, পানি জৈব ও অজৈব অনেক পদার্থকে দ্রবীভূত করতে পারে অর্থাৎ পানি একটি সার্বজনীন দ্রাবক। |
এবার তোমরা পানির বদলে অন্য একটি দ্রাবক যেমন-স্পিরিট নিয়ে উপরে উল্লেখিত প্রতিটি দ্রব নিয়ে পরীক্ষা করে দেখ। এগুলো স্পিরিটে দ্রবীভূত হয় কিনা। সবগুলো দ্রব কি স্পিরিটে দ্রবীভূত হচ্ছে? না, হচ্ছে না। পানি ছাড়া বেশির ভাগ দ্রাবকই (যেমন স্পিরিট) কম সংখ্যক দ্রবকে দ্রবীভূত করে। তাই সেগুলো সার্বজনীন দ্রাবক নয়।
এ অধ্যায়ে আমরা যা শিখলাম
শূন্যস্থান পূরণ কর
১. মৌলিক পদার্থ ________ উপাদান দিয়ে তৈরি।
২. লবণ ও চিনি _________ পদার্থ
৩. মৌলিক পদার্থের ক্ষুদ্রতম কণার নাম ________ .
8. _________ হলো যৌগিক পদার্থের ক্ষুদ্রতম কণা।
৫. পরমাণুর কেন্দ্রে __________ থাকে।
সংক্ষিপ্ত প্রশ্ন
১. মৌলিক ও যৌগিক পদার্থ বলতে কী বোঝায়?
২. অণু ও পরমাণুর মধ্যে পার্থক্য উদাহরণসহ ব্যাখ্যা কর।
৩. ডাল্টনের পরমাণুবাদের মূল বক্তব্য কী?
৪. পরমাণু ভেঙে কী কী কণা পাওয়া যায়? এরা পরমাণুর কোথায় অবস্থান করে?
বহুনির্বাচনি প্রশ্ন
১. কোনটি মৌলিক পদার্থের অণু?
ক. Η
খ. Ne
গ. N
ঘ. NO
নিচের উদ্দীপকের আলোকে ২ ও ৩ নং প্রশ্নের উত্তর দাও।
| পদার্থ | প্রতীক | সংকেত |
| ১ | C12 | |
| ২ | Al | |
| ৩ | O3 | |
| ৪ | Br2 | |
| ৫ | NH3 | |
| ৬ | NaOH | |
| ৭ | Cu |
২. উপরের ছকে প্রতীক ও সংকেতের মাধ্যমে প্রকাশিত একই ধর্মের মৌল কোনগুলো?
ক. ২,৪
খ. ১,৩
গ. ১,৪
ঘ. ২, ৬
৩. কোন পদার্থের অণুতে পরমাণুর সংখ্যা সমান?
ক. ২, ৩
খ. ৩, ৪
গ. ৪,৫
ঘ. ৩, ৬
সৃজনশীল প্রশ্ন
১. নিচের ছকে তিনটি পদার্থ এবং তাদের গঠনকারী পরমাণু সংখ্যা উল্লেখ করা হলো।
| পদার্থ | পরমাণুর সংখ্যা |
| ১ | Na - ১টি CI- ১টি |
| ২ | F - ২টি |
| ৩ | C - ১টি ০ - ২টি |
ক. হিলিয়ামের প্রতীক কী?
খ. কার্বন কেন মৌলিক পদার্থ? বর্ণনা কর।
গ. ১ নং পদার্থটির সংকেতসহ রাসায়নিক নাম লেখ এবং গঠন প্রক্রিয়া ব্যাখ্যা কর।
ঘ. ছকের ২ নং পদার্থ মৌলিক এবং ৩নং পদার্থ যৌগিক ব্যাখ্যা কর।
২.
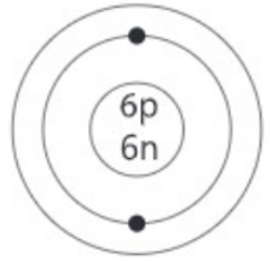
ক. পরমাণু কী?
খ. O এবং O2 এর মধ্যে পার্থক্য কী?
গ. দ্বিতীয় কক্ষ পথে যে কয়টি ইলেকট্রন থাকবে তা বসিয়ে চিত্রটি আঁক।
ঘ. তোমার আঁকা চিত্রটির স্বপক্ষে যুক্তি দাও।
common.read_more